Theorie
Inhalt
1. Bedeutung des Brauwassers
Dass Bier je nach Alkoholgehalt zu 90-95% aus Wasser besteht sagt viel über die Bedeutung des Brauwassers aus. Ungeachtet dessen lassen wir Hobbybrauer das Thema Wasser gerne links liegen - zuviel Chemie, meint man! Aber es gibt eine gute Nachricht: macht nix! Zumindest meistens. Denn wenn wir nicht gerade mit betonhartem Wasser brauen, kommt in aller Regel am Ende trotzdem leckeres Bier heraus. Und manchmal wird um das Thema Brauwasser auch einfach zu viel Wind gemacht. Aber: das Brauwasser kann eine Ursache dafür sein, dass bei zwei Hobbybrauern ein mit gleichem Equipment und identischen Zutaten und Rezept gebrautes Bier sehr unterschiedlich schmecken kann. Vielleicht ist die Bittere bei dem einen etwas betonter oder nachhängender, die Sudhausausbeute ist etwas verschieden und bei Axel vom regelmässigen Hobbybrauerstammtisch schmeckt das Pilsner einfach immer saulecker! Wer also seinem Bier den letzten Schliff geben will oder einfach ein authentisch schmeckendes Dortmunder Export mit "Dortmunder Wasser" brauen will, muss in aller Regel sein Wasser in irgendeiner Form aufbereiten.
Das Brauwasser aus dem Wasserhahn ist chemisch kein reines Wasser, also pures H2O, sondern enthält zahlreiche gelöste Salze und andere Stoffe in unterschiedlicher Konzentration. Diese wirken entweder durch Ihren Einfluss auf den pH-Wert der Maische direkt auf die Effizienz des Maischprozesses (HCO3-, Ca2+, Mg2+) oder auf die Stabilität einiger im Maischprozess relevanten Enzyme. Eine Reihe von Salzen oder deren Ionen, wie z.B. Chlorid (Cl-) oder Sulfat (SO42-), können in Abhängigkeit von ihrer Konzentration einen markanten geschmacklichen Einfluss auf das fertige Bier haben. Zudem sind eine handvoll Spurenelemente für das Hefewachstum und damit für eine erfolgreiche Gärung essenziell.
Wenn man sich das erste mal inhaltlich mit dem Thema Brauwasser auseinandersetzt fliegen einem in der Literatur oder im Hobbybrauerforum zahllose exotische und teils einschüchternde Begriffe um die Ohren. Aber keine Angst, wenn man verstanden hat was Restalkalität ist und welchen Einfluss sie auf den pH-Wert der Maische hat, dann hat man eigentlich 99% im Sack! Und darum geht's in den nächsten beiden Kapiteln.

2. Alkalität und Restalkalität
Während des Einmaischens wird das Brauwasser durch das Malz angesäuert, d.h. es reichern sich H+-Ionen (oder genauer Hydronium-Ionen, H3O+) im Brauwasser an, was zu einem Abfall des pH-Wertes führt. Dabei verhalten sich dunkle Malze generell saurer als hell abgedarrte Malze. Ungehindert senkt sich der pH-Wert dadurch von allein in einen für den Maischprozess günstigen Bereich (pH 5,3-5,7).
Der Knackpunkt ist allerdings, dass die meisten Wässer das Bestreben haben sich diesem pH-Abfall zu widersetzen. Dieses Alkalität genannte Phänomen gründet in der Konzentration eines Ions: Bicarbonat oder chemisch HCO3-. Das HCO3- fängt die H+-Ionen einfach ab und reagiert dabei zu Wasser und Kohlendioxid (H+ + HCO3- → H2O + CO2). Die pH-Wert-senkende Wirkung der H+-Ionen verpufft somit wirkungslos. Dieser Effekt ist um so größer, je mehr HCO3- im Wassser vorhanden ist.
In die entgegengesetzte Richtung wirken Kalzium und Magnesiumionen. Sie reagieren mit Phosphaten aus dem Malz und produzieren dabei H+-Ionen: 3 Ca2+ + 2 HPO42- → 3 Ca3(PO4)2 + 2H+. Die freigesetzten H+-Ionen reagieren wie weiter oben besprochen mit HCO3- zu Wasser und Kohlendioxid und nehmen dadurch im Verhältnis 1:1 HCO3--Ionen, also Alkalität, aus dem System. Schon in der Mitte des vergangenen Jarhunderts konnte der luxemburgische Brauwissenschaftler Paul Kolbach zeigen, dass etwa 1,75 Kalzium- oder 3,5 Magnesiumionen benötigt werden, um ein H+-Ion freizusetzen. Ein H+-Ion ist in der Lage die säurevernichtende Wirkung eines HCO3--Ions aufzuheben und damit die Alkalität des Brauwassers zu senken. Ein Maß für die resultierende Pufferwirkung, die sich aus dem Zusammenspiel der säurevernichtenden HCO3--Ionen und den säurefördernden (weil HCO3- vernichtenden) Kalzium- bzw. Magnesiumionen ergibt, ist die Restalkalität. Je höher die Restalkalität, desto besser ist das Wasser gegen eine Senkung des pH-Werts gepuffert. In der Brauwelt hat sich deshalb folgende Formel für die Berechnung der Restalkalität etabliert:
Gleichung 1: Restalkalität (RA) [mmol/l] = HCO3- [mmol/l] - Ca [mmol/l]/1,75 - Mg [mmol/l]/3,5
Kleiner Exkurs zu mol/l bzw. mmol/l: die Stoffmengenkonzentration (Einheit mol/l) gibt an, wieviele Teilchen, d.h. Atome, Moleküle oder Ionen, multipliziert mit 6,022 x 1023 sich in einem bestimmtem Volumen befinden. Je nach Art des Teilchens, können 6,022 x 1023 Stück davon (d.h. 1 mol), unterschiedlich schwer sein: Kalzium wiegt z.B. 40,08 g/mol (so genanntes Molekulargewicht) und das leichtere Magnesium nur 24,31 g/mol. Ionen haben übrigens das gleiche Molekulargewicht wie ihre entsprechenden Atome bzw. Summe ihrer Atome, d.h. Ca2+ (ein Kalziumatom, dem 2 Elektronen fehlen) wiegt genau so viel wie Ca, also 40,08 g/mol.
Die Definition des Mols als 6,022 x 1023 Teilchen ist übrigens ein spannendes Stück Wissenschaftsgeschichte: so viele Teilchen sind in 12 g des Kohlenstoff-Isotops C-12 enthalten. Der Einfachheit halber kann man sich ein mol auch als ein Teilchen vorstellen, auch wenn wir wissen das es eigentlich viel mehr sind.
Dividieren wir jetzt die Masse eines Stoffes (in g) mit seinem Molekulargewicht (in g/mol), wissen wir mit wieviel Teilchen (in mol) wir es zu tun haben. So entsprechen z.B. 45 mg Kalzium gleich 1,12 mmol (45/40,08=1,12), wohingegen 45 mg Magnesium gleich 1,85 mmol, also mehr als der anderthalb-fachen Anzahl an Atomen/Ionen, entsprechen. Die Stoffmenge ist also wichtig, damit wir Äpfel mit Äpfeln vergleichen können wenn wir chemisch rechnen wollen. Wem die Sache immer noch nicht ganz klar sein sollte, dem hilft evtl. folgendes Gedankenspiel: wenn 1 H+-Ion genau ein Bikarbonat-Ion wegfängt (H+ + HCO3- → H2O + CO2), kann man dann sagen, dass 1 mg H+-Ionen 1 mg HCO3- wegfangen? Natürlich nicht, da das HCO3- viel schwerer ist und 1 mg HCO3- daher weniger Teilchen entsprechen als 1 mg H+-Ionen. Rechnen wir das Gewicht allerdings vorher in die entprechende Stoffmenge (also Teilchen) um funktioniert es, denn 1 mol H+-Ionen sind haargenau soviele Teilchen wie 1 mol HCO3--Ionen.
Die Restalkalität ist nach Gleichung 1 also die Menge an HCO3- in mmol/l, die unter Einbeziehung der Kalzium- und Magnesiumkonzentration im System verbleiben. Eine Restalkalität von 0 entspricht 0 mmol/l HCO3- und entspricht den Verhältnissen in frisch destilliertem Wasser. Eine negative Restalkalität ist auch möglich. Diese beschreibt dann den durch die Kalzium- und Magnesiumionen hervorgerufenen Überschuss an H+-Ionen.
Gleichung 1 zeigt auch deutlich, dass ein Wasser mit einer hohen HCO3--Konzentration durchaus eine niedrige Restalkalität besitzen kann, solange eine ausreichend hohe Menge an Kalzium- und Magnesium-Ionen vorhanden ist, um diese zu kompensieren.
Damit wäre das Thema Restalkalität eigentlich abgehandelt. Weniger kompliziert als gedacht, was? Bikarbonat, Kalzium und Magnesium - drei Parameter, dass ist schon alles. Was ist aber jetzt etwa mit der Karbonathärte, Nichtkarbonathärte, Kalziumhärte, Gesamthärte, Säurekapazität und all den tausend Begriffen und Einheiten, welche einem entgegenspringen wenn man auch nur flüchtig auf die Trinkwasseranalyse seines Wasserversorgers oder in ein Braulehrbuch zum Thema Wasser und Restalkalität schaut? Die fantastisch gute Nachricht ist: sie sind für das Verständnis der Restalkalität vollkommen belanglos! Sie sind historisch gewachsene und regional gefärbte Ausdrucksformen einer oder mehrer der drei Parameter. Ähnlich wie wenn man in einem Kochrezept von drei Tassen Reis anstelle von 150 g Reis spricht. Andererseits kommen wir nicht umhin uns in irgendeiner Weise trotzdem mit diesen Begriffen auseinanderzusetzen damit wir beim Schmökern einschlägiger Literatur oder bei einer Fachsimpelei im Forum oder beim Hobbybrauertreffen wissen wovon die Rede ist. Mehr dazu im Kapitel 5. Jetzt geht's erst mal um das zentralste aller zentralen Themen, das Innere des Heiligtums, den heiligen Gral der Brauchemie - den Maische pH-Wert.

3. pH-Wert der Maische
Die Restalkalität ist eine enorm wichtige Größe, um die Beschaffenheit und die Pufferwirkung des Brauwassers zu charakterisieren. Was uns Brauer jedoch eigentlich interessiert, ist der aus der Restalkalität und den verwendeten Malzen resultierende pH-Wert der Maische, also jener pH-Wert der sich nach Einmischen des Malzes in das Brauwasser ergibt.
Der Maische-pH-Wert ergibt sich aus der Menge der aus dem Malz frei werdenden H+-Ionen - das Malz ist quasi eine "Säure" - und den vorhandenen HCO3--Ionen, welche die Säuren abfangen - der Restalkalität (die "Säurevernichterin"). Und damit ist der Theaterboden für die Schlacht zwischen Gut und Böse auch schon ausgelegt! Wir Brauer sind dabei die Regisseure und können den pH-Wert entweder über die Auswahl des Malzes und/oder die Änderung der Restalkalität beeinflussen. Malz enthält eine Vielzahl schwacher Säuren. Bei dunklen, höher abgedarrten Malzen ist der Säuregehalt oft höher als bei hellen Malzen, wobei es jedoch eine Reihe an Ausnahmen gibt. Basierend auf Experimenten von Kai Troester (Quelle: Kai Troester 2009) habe ich mit zahlreichen Basis-, Spezial- und Caramalzen experimentiert und ein Modell zur Vorhersage des Maische-pH-Wertes auf Basis der Farbe der einzelnen Bestandteile der Schüttung erstellt (siehe hier), worauf auch die Maische-pH-Wert Vorhersage dieses Rechners basiert.
Der ideale Maisch-pH liegt allgemein akzeptiert zwischen 5.3 und 5.7 und stellt eine optimale Enzymaktivität der Maischenzyme sicher. Weiterhin beeinflusst der Maische-pH auch den pH-Wert aller weiteren im Brauprozess relevanten Schritte angefangen von einer reduzierten Gerbstofflöslichkeit und erhöhten Läutereffizienz über verbesserter Würzetrubbildung und verringerter Farbintensivierung während des Würzekochens bis hin zur Förderung gesunder und fiter Hefezellen und damit einer erfolgreiche Gärung (siehe auch Kapitel 4).
Historisch gesehen, wurde (und teilweise wird) mit dem Wasser gebraut, welches vor Ort zur Verfügung stand. Besitzt das Einmaischwasser eine hohe Restalkalität werden die H+-Ionen des Malzes abgefangen und die pH-Wert Absenkung wird schwächer ausfallen. Da dunkle Malze eher etwas saurer sind als helle Malze, tolerieren Maischen mit einem hohen Anteil dunkler Malze (z.B. Münchner Malz) oder Spezialmalzen (z.B. Caramalz) eine höhere Restalkalität als Maischen mit vorrangig hellen Malzen (z.B. Pilsner Malz). In Brauzentren mit Wasser, welches eine relativ hohe Restalkalität aufweist, werden traditionell deshalb auch eher dunkle Biere gebraut (z.B. München, dessen Wasser eine hohe HCO3--Konzentration besitzt). Im Gegensatz dazu konnten z.B. die Pilsner Braumeister mit ihrem extrem weichen Wasser es sich erlauben ausschließlich mit hell abgedarrtem Malz zu brauen. Ein hopfiges Pilsner in München zu brauen war wasserbedingt bis weit ins 20. Jh. schlichtweg nicht möglich.
Generell lohnt es sich m.E. den Maisch-pH, z.B. mit einem pH-Meter, zu überprüfen, um einen Bereich vollkommen jenseits von gut und böse (z.B. pH <5.2 oder >5.8) zu vermeiden,
oder aber auch um die Wirkung der eigenen Wasseraufbereitungsmaßnahmen zu bewerten und seinem Bier geschmacklich den letzten Schliff zu geben.

4. Bedeutung der Restalkalität und des pH-Wertes
Wir haben jetzt mehrfach vom optimalen pH-Bereich gesprochen. Aber warum ist dieser pH-Bereich für uns so wichtig? Folgende Gründe lassen sich dafür anführen:
die Enzymaktivitäten der stärkespaltenden Enzyme (Amylasen) haben ihre Optima bei pH 5,4 (β-Amylase) bzw. 5,6 (α-Amylase)
geringere Viskosität der Maische → effizienteres Läutern
niedrigere Hopfenausnutzung gegenüber höheren pH-Werten, dafür rundere und weniger harsche Hopfenbittere
siginifikant niedrigere Tanninlöslichkeit bei pH<6
niedrigere Farbintensivierung der Würze während des Kochens → hellere Biere
verbesserte Proteinkoagulation (Eiweißbruch) während des Würzekochens
höhere Wachstumsraten der Hefe in der Gärung → sauberere Gärung und höherer Endvergärungsgrad
Der pH-Wert der Maische bestimmt also nicht nur die Effizienz der Stärkespaltung, sondern ist der Ausgangspunkt für den pH-Wert in allen weiteren Brauschritten (Würzekochen, Gärung) und im fertigen Bier. Der niedrige pH-Wert des fertigen Bieres (<4.5) ist z.B. einer der Gründe warum Bier zu allen Zeiten ein "sicheres" Lebensmittel gewesen ist. Der pH-Wert im fertigen Bier hat auch direkte geschmackliche Auswirkungen, wobei ein niedriger pH-Wert mit lebhafterem, knackigeren Geschmack in Verbindung gebracht wird und einem höheren pH-Wert ein dumpfer Beigeschmack nachgesagt wird.
Damit wäre eigentlich zum Verständnis Restalkalität und Maische-pH-Wert alles gesagt - wären da nicht die vielen historisch gewachsenen und teilweise verwirrenden Begrifflichkeiten, die, insbesondere hinsichtlich der Alkalität und Restalkalität, in der Wasser- und Brauwelt existieren. Darum geht's im nächsten Abschnitt.

5. Andere Konzentrationsangaben: °dH, °fH, mval und Co.
Was tun wenn in der Trinkwasseranalyse z.B. hinter der Kalziumkonzentration kein mg/l oder mmol/l steht? Oftmals wird vom Wasserversorger die Konzentration der uns interessierenden Ionen in Härtegraden oder noch exotischeren Einheiten, wie z.B. mval/l angegeben. So wird z.B in Deutschland und Österreich oft das Grad deutscher Härte (°dH) und in der Schweiz das Grad französischer Härte (°fH) verwendet. Obwohl der Wasserrechner auf dieser Seite all diese Einheiten schluckt, schadet es sicher nicht wenn man damit umgehen kann.
1°dH ist als die Wasserhärte definiert, die durch 10 mg CaO in einem Liter Wasser hervorgerufen wird. 1°fH entsprechen 10 mg CaCO3 / l und 'ppm als CaCO3' (wird oft im amerikanischen Raum verwendet), bezeichnet die jeweilige Menge an Härtebildnern in mg/l, die der gleichen Menge in mg/l CaCO3 entspricht.
Wichtig zum Verständnis ist, dass die so angegebenen Werte über das entsprechende Molekulargewicht einfach in Stoffmengenkonzentrationen umgerechnet werden können. CaO hat z.B. ein Molekulargewicht von 56.08 g/mol. 10 mg/l CaO (d.h. 1° dH) entprechen daher 10 mg/l ÷ 56.08 g/mol = 0.178 mmol/l CaO und damit auch 0.178 mmol/l Ca2+ oder Mg2+. Für das °fH ist die Berechnung analog: Molekulargewicht CaCO3 = 100.09 g/mol → 10 mg/l CaCO3 ÷ 100.09 g/mol = 0.1 mmol/l CaCO3 bzw. Ca2+ oder Mg2+.
Oft wird die Härte auch in so genannten äquivalenten (Einheit val, 1 val = 1000 mval) angegeben. Sie berücksichtigt neben der Stoffmengenkonzentration noch die Ladung der einzenlnen Ionen. Kalzium und Magnesium Ionen sind 2-fach positiv geladen (Ca2+ bzw. Mg2+), d.h. 1 mmol Ca = 2 mval Ca ; HCO3- ist 1-fach negativ geladen, d.h. 1 mmol HCO3- entsprechen auch 1 mval HCO3-. Eine Kalzium- oder Magnesiumhärte von 1°dH entsprechen daher 0.178 mmol/l (siehe weiter oben) bzw. 0.356 mval (oder andersherum 1 mmol/l = 5,612 °dH; 1 mval/l = 2,804 °dH). Analog entsprechen 1°fH an Kalzium- oder Magnesium 0.1 mmol/l (siehe oben) bzw. 0.2 mval (1 mmol/l = 10 °fH; 1 mval/l = 5,0 °fH). Das Gleiche gilt für die Gesamthärte, die ja die Summe aus Ca2+ und Mg2+ darstellt.
Die HCO3--Konzentration wird vom Wasserversorger oft als Säurekapazität bis pH 4,3 angegeben. Beide Werte (in mmol/l) sind miteinander austauschbar. Die Säurekapazität wird durch die Zugabe einer starken Säure (i.d.R. 0,1 M HCl) zum Wasser bis zum Erreichen des pH-Wertes von 4,3 ermittelt (sogenannte Titration). Beim Erreichen dieses pH-Wertes ist der gesamte Vorrat an HCO3--Ionen erschöpft. Da das HCO3- das einzig relevante Ion mit Pufferwirkung im Wasser ist, ist die Menge an zugegebener Säure in mmol/l dabei identisch mit der HCO3--Konzentration in mmol/l.
Die Bikarbonatkonzentration bzw. der dazu äquivalente Teil an Ca2+ bzw. Mg2+-Ionen wird auch als Alkalität bzw. Karbonathärte bezeichnet. Da jeweils 2 mmol HCO3- mit 1 mmol Ca2+ (bzw. Mg2+) assoziiert sind (Ca2+ + 2 HCO3-) ergibt sich die Definition der Karbonathärte: 1°dH = 2 ⋅ 0.178 mmol/l Ca2+ = 0.356 mmol/l HCO3- und 1°fH = 2 ⋅ 0.1 mmol/l Ca2+ = 0.2 mmol/l HCO3-.
Die Einheiten val, °dH, usw. sind nicht SI-konform und sollten daher, zumindest in der Wissenschaft, nicht verwendet werden. Meiner Meinung nach ist es daher besser, die SI-konformen - und leicht verständlicheren! - Einheiten mmol/l und mg/l zu nutzen, auch wenn wir Brauer uns daran erst gewöhnen müssen. International sind diese zudem sehr einfach vergleichbar - denn was wissen ein Amerikaner oder Neuseeländer (oder auch der Schweizer!?) wieviel 1°dH ist???!!! (Anmerkung: die haben natürlich ihre eigenen krassen Einheiten!)

6. Möglichkeiten zur Veränderung der Restalkalität
6.1. Kalzium- und Magnesiumsalze
Wie weiter oben erwähnt kann die Restalkalität durch Zugabe von Kalzium- und Magnesiumsalzen gezielt verringert werden. Der vorliegende Rechner bietet die Möglichkeit, Kalzium in Form von Gips (Kalziumsulfat) und Kalziumchlorid und Magnesium in Form von Bittersalz (Magnesiumsulfat) zuzugeben. Neben den Kalzium- bzw. Magnesiumionen werden dem Wasser dabei natürlich noch die entsprechenden Anionen, d.h. Sulfat bzw. Chlorid, zugesetzt, welche ihrerseits den Geschmack des Bieres beeinflussen können, aber dazu später mehr.
6.2. Milchsäure und Sauermalz
Eine weitere Möglichkeit besteht in der Zugabe von Säure. Im Hobbybrauerbereich ist Milchsäure sehr verbreitet. Bei Maische-pH Werten, also im Berreich pH 5-6, liegen nahezu alle Milchsäuremoleküle dissoziiert als je ein Lactat-Ion und ein H+-Ion vor (der pKS-Wert der Milchsäure beträgt 3,90). D.h., 1 mol Milchsäure kann genau 1 mol HCO3- neutralisieren. Sind das Molekulargewicht der Milchsäure (90,08 g/mol), ihre Dichte (1,206 g/ml), sowie die Konzentration, welche zur Anwendung kommen soll (i.d.R. 80 Gew.-%, ist im vorliegenden Rechner jedoch frei wählbar) bekannt, kann die Menge freigesetzter H+-Ionen genau berechnet werden. Als Formel ausgedrückt verrringert sich die Restalkalität bei Zugabe von Milchsäure also wie folgt:
Gleichung 2: RAnach [mmol/l] = RAvor - (Milchsäure [ml] · 1,206 g/ml · (80 Gew-%/100) · 1000 (Umrechnung mol zu mmol) · 1/Volumen Brauwasser · 1/90,08 g/mol
Durch Division mit dem schon bekannten Faktor 0,3566 kann diese Reduktion auch als °dH ausgedrückt werden. 3,3 ml einer 80 Gew-%igen Milchsäure auf 100 L Brauwasser reduziert die RA daher um 1°dH:
Gleichung 3: RAnach [°dH] = RAvor -(3,3 · 1,206 · (80/100) · (1000) · (1/100) · (1/90,08) · (1/0,3566)) = -1
Alternativ zu Milchsäure kann der Maische auch ein gewisser Anteil an Sauermalz zugesetzt werden. Sauermalz enthält zwischen 1-3% Milchsäure. In gewissen Grenzen kann daher abgeschätzt werden, wieviel Milchsäure der Maische zugeführt wird. Der vorliegende Rechner trifft die Annahme, dass das Sauermalz 2% Milchsäure, also 2 g Milchsäure je 100 g Sauermalz, enthält. Aus der resultierenden Gewichtskonzentration kann über die Molare Masse der Milchsäure in die entsprechende Stoffmengenkonzentration in mmol/l umgerechnet werden Zum Beispiel: 100 g Sauermalz in 10 L Brauwasser = 2 g Milchsäure/ 10 L = 200 mg/L = 200/90,08 = 2,2 mmol/l. Den Rest hatten wir schon: 2,2 mmol Milchsäure neutralisieren 2,2 mmol HCO3- und senken die Restalkalität ebenfalls um 2,2 mmol oder um 6,2°dH (2,2/0,3566=6,2).
6.3. Natriumhydrogenkarbonat (Backsoda)
Obwohl man in den meisten Fällen mit einer zu hohen Restalkalität konfrontiert ist, gibt es auch Situationen, die eine gezielte Erhöhung der Restalkalität erfordern, um den pH-Wert der Maische im Optimum zu halten. Dies könnte z.B bei Brauwasser der Fall sein, welches von vornherein eine sehr geringe Restalkalität aufweisst, und welches zusätzlich noch mit Kalzium- oder Magnesiumsalzen aufgehärtet wird, um ein bestimmtes Ionenprofil einzustellen. Wird hier noch mit sehr sauren Malzen (siehe unten) gearbeitet, kann der Maisch-pH unter 5,2-5,3 sinken. In einer solchen Situation könnte man über eine Zugabe von HCO3-, z.B. in Form von NaHCO3 (Natriumhydrogenkarbonat oder Backsoda), nachdenken. 1 mmol/l NaHCO3 bzw. 0,084 g/l erhöhen die Restalkalität um genau 1 mmol/l (=2,8°dH).
6.4. Vorbehandlung mit CaO
HCO3- lässt sich effektiv durch Vorbehandlung mit gebranntem Kalk (CaO = Kalziumoxid) über eine Fällungsreaktion Wasser mit hoher Karbonathärte entfernen. Dazu wird eine definierte Menge CaO zunächst mit etwas Wasser vermischt, wobei Kalziumhydroxid und ordentlich Wärme entsteht:
Gleichung 4: CaO + H2O → Ca(OH)2
Diese Kalkmilch genannte Lösung wird dann einfach in das aufzubereitende Wasser gegeben. Dabei reagiert das Ca(OH)2 mit dem im Wasser enthaltenen HCO3-, wobei CaCO3 entsteht:
Gleichung 5: Ca(OH)2 + Ca(HCO3)2 → 2 CaCO3 ↓ + 2 H2O
Das CaCO3 setzt sich innerhalb einiger Stunden ab (der Erfolg kann demnach direkt überprüft werden) und der überstand kann dann einfach, z.B. mit einem Siphon, abgezogen werden. Für jedes eingesetzte Mol CaO entfernen wir jeweils 2 mol HCO3-, sowie 2 mol Ca2+-Ionen (ja richtig, wir entfernen effektiv also zusätzlich 1 mol Ca2+-Ion pro mol CaO - der Rechner berücksichtigt das aber!).
Obwohl die Methode einfach und ohne großen Energieaufwand durchgeführt werden kann ist Vorsicht geboten: ist der Vorrat an HCO3--Ionen im Wasser aufgebraucht verbleibt die überschüssige Kalkmilch als Ca(OH)2 - also einer Lauge - im System zurück und führt zu einem Ansteigen des pH-Wertes, also dem Gegenteil dessen was wir eigentlich beabsichtigt hatten - mit allen daraus resultierenden negativen Folgen für den weiteren Maisch- und Brauprozess. Um dem Vorzubeugen warnt der Wasserrechner bei einer im Verhältnis zur HCO3--Konzentration zu großen Menge an CaO vor überkalkung. Generell wird zudem die Annahme getroffen, das alle Reaktionen vollständig ablaufen. Auf der sicheren Seite ist man daher wenn man in der Praxis zur überkalkung einen gewissen Sicherheitsabstand einhält.
Weiterhin muss man im Hinterkopf behalten, dass mit dieser Vorgehensweise nur die Karbonathärte entfernt werden kann und hier effizient auch nur der mit Kalzium assoziierte Anteil der Karbonathärte (Ca(HCO3)2). Ist der Kalziumanteil der Karbonathärte aufgebraucht, d.h. es ist gemäß Gleichung 5 kein Ca(HCO3)2 im Wasser vorhanden um noch als CaCO3 auszufallen, warnt der Rechner.
6.5. Karbonathärte entfernen durch Erhitzen
Das hat wahscheinlich jeder schon einmal beobachtet: wird Wasser mit hoher Karbonathärte erhitzt, setzt sich weißer Kalk ab. CO2 (bzw. Kohlensäure - H2CO3) und Karbonationen (CO32-) liegen im Wasser in Abhängikeit vom pH-Wert in unterschiedlichen Konzentrationsverhältnissen vor (so genanntes Kalk-Kohlensäuregleichgewicht). Wird Wasser erhitzt, gast das CO2 aus und das System hat das bestreben ins Gleichgewicht zurückzukehren. Dies geschieht durch Bildung von CO2 aus HCO3-, wobei zusätzlich unlösliches CaCO3 entsteht:
Gleichung 6: HCO3- → CaCO3 ↓ + CO2
Den Rest hatten wir im Prinzip schon: Das CaCO3 setzt sich nach einigen Stunden ab und der überstand kann analog zur Fällung mit CaO abgezogen werden. Der Nachteil dieser Methode gegenüber der Vorbehandlung mit CaO ist der hohe Energiebedarf, insbesondere bei großen Wassermengen. Andererseits besteht hier nicht die Gefahr einer überkalkung.

7. Anpassen des Ionenprofils
Neben ihrer Bedeutung hinsichtlich des pH-Wertes, kann die Ionenzusammensetzung des Brauwassers auch einen spürbaren geschmacklichen Einfluss auf das fertige Bier haben. Allen voran seien die Sulfat und Chlorid-Ionen genannt. Ist das Ionenprofil des eigenen Brauwassers bekannt, kann man versuchen durch Zusatz verschiedener Salze das Ionenprofil eines anderen Wassers zu imitieren. Dies könnte z.B. ein Wasser aus einem der berühmten, klassischen Brauzentren der Welt, wie München, Dortmund, Pilsen, Burton-upon-Trent, London oder Dublin, sein. Die Entwicklung chemischer Analysen erlaubte es seit dem ausgehenden 19.Jh die verschiedenen Brauwässer zu analysieren und miteinander zu vergleichen. In der Brauliteratur sind eine Reihe dieser historischen Analysen publiziert, die jedoch teilweise kontroverse Daten liefern. Nachfolgende Tabelle gibt die Ionenzusammensetzung einiger Brauzentren nach Hough wider:
Tabelle: Ionenzusammensetzung einiger historisch bedeutender Brauzentren
(Quelle: J.S. Hough, The Biotechnology of Malting and Brewing, Cambridge University Press)
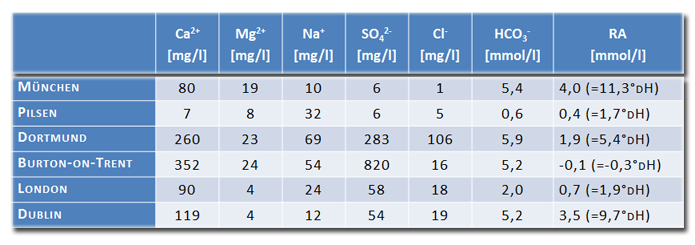
Bei der Zugabe von Salzen sollte man sich darüber im Klaren sein, dass dem Wasser jeweils zwei verschiedene Ionen zugeführt werden. Bei CaSO4 z.B.: Kalzium und Sulfat. Bei CaCl2: Kalzium und Chlorid. Es ist daher leicht möglich durch die gewollte Zugabe eines Ions mit der Konzentration des anderen Ions über das Ziel hinaus zu schießen. Hier muss von Fall zu Fall und unter Einbeziehung der Ionenzusammensetzung des unbehandelten Wassers und des Zielwertes entschieden werden, welche Strategie den gewünschten Erfolg verspricht. Weiterhin sollte man den Zweck der Wasseraufbereitung im Hinterkopf behalten. So eignet sich z.B. ein nach dem Münchner Wasserprofil aufbereitetes Wasser nicht zum Brauen eines Pilsners bzw. ein Pilsner Wasser nicht unbedingt zum Brauen eines dunklen Biers.
Dortmunder Wasser, welches traditionell z.B. für die Herstellung von Export verwendet wurde, zeichnet sich neben seiner hohen Karbonathärte, durch eine relativ hohe Sulfat- und Chloridkonzentration aus. Bei entsprechend niedrigen Werten im Rohwasser, kann dem Wasser Sulfat durch CaSO4 zugeführt werden, um mit Sulfatkonzentrationen zwischen 200-300 mg/l Dortmunder Verhältnisse zu erzeugen. Die Zugabe von CaSO4 erniedrigt zudem zusätzlich die Restalkalität. Die Restalkalität kann evtl. weiter mit Milchsäure oder Sauermalz auf Werte zwischen 0 und 2 mmol/l (=0-5°dH) gesenkt werden. Vielleicht kann auch über eine Spur NaCl (Kochsalz) nachgedacht werden, um die Cloridwerte in den Bereich 60-100 mg/l zu bringen.
Im Gegensatz dazu hat Pilsner Wasser eine sehr niedrige Karbonathärte und ist sehr arm an fast allen Mineralien. Für die meisten Hobbybrauer bedeutet dies, dass an Stelle etwas hinzuzufügen, etwas aus dem Wasser herausgenommen werden muss. Die einfachste Variante wäre z.B. ein Verschnitt mit destilliertem Wasser und eine zusätzliche Erniedrigung der Restalkalität mit Milchsäure oder Sauermalz. Anzustreben sind Restalkalitäten <-2 mmol/l (<-5°dH), vor allem wenn auschließlich Pilsner Malz verwendet wird. Wenn eine Erniedrigung der Restalkalität durch Salzzugabe erfolgen soll, dann höchstens mit CaCl2. Von einem Zusatz von CaSO4 ist abzusehen, da eine hohe Sulfatkonzentration eine kratzige Bittere hervorrufen soll und sich daher nicht mit der edlen und betonten Bittere des Pilsners verträgt.
Im Vergleich dazu besitzt Wasser aus Burton-upon-Trent in England, welches für sein India Pale Ale Weltberühmtheit erlangte, prinzipiell viel von allem. Seine hohe Karbonathärte wird durch eine hohe Kalziumkonzentration (>300 mg/l) in Schach gehalten. Die Sulfatkonzentration des Brauwassers liegt bei astronomischen Werten über der 800 mg/l Marke. Bitters, Pale Ales und Barley Wines kann man daher am besten mit CaSO4 aufsalzen und braucht Sulfatkonzentrationen >200 mg/l nicht zu scheuen. Evtl. kann auch noch etwas MgSO4 zugesetzt werden, um eine Magnesiumkonzentration von 20-30 mg/l zu erzeugen.
Londoner Wasser, z.B. für Mild und Brown Ales, Stouts und Porters besitzt eine moderate Karbonathärte. Zusammen mit der relativ hohen Kalziumkonzentration ergibt sich eine erstaunlich niedrige Restalkalität. Auf der Nachbarinsel sind die Verhältnisse etwas anders: Dubliner Wasser besitzt eine relativ hohe Karbonathärte. Die Kalziumkonzentration des Dubliner Wassers reicht jedoch nicht aus, die Restalkalität deutlich zu senken, weshalb die Iren vor allem für ihr pechschwarzes Stout berühmt wurden. Restalkalitäten um 2-3 mmol/l (ca. 5-10°dH) sind akzeptabel, insofern ein gewisser Anteil säurereicher dunkler Röst- und Spezialmalze seinen Weg in die Maische findet.
Die Zusammensetzung des karbonatreichen Münchner Wassers erlaubte die Herstellung schwach gehopfter, dunkler und malzbetonter Biere, wie z.B. Münchner Dunkel, Märzen oder Oktoberfestbier. Eine Restalkalität >2 mmol/l (ca. 5°dH) verhindert, dass der pH-Wert der Maische bei der Verwendung dunkler und säurereicher Basis- und Spezialmalze zu weit in den Keller rutscht. Die Sulfatkonzentration sollte, gemäß dem Müncher Wasser, niedrig sein, um eine milde und sanfte Bittere zu erzeugen. Bei sehr hohen Sulfatkonzentrationen im unbehandelten Wasser (>150-180 mg/l), sollte man evtl. über eine Verschneidung mit dest. Wasser nachdenken. Ein Anteil von 20% dest. Wasser (bei 25l Brauwasser z.B. 20l Rohwasser + 5l dest. Wasser) senkt auch alle Ionen um 20%. Falls notwendig, sollte zur Senkung der Restalkalität bevorzugt CaCl2 oder Milchsäure an Stelle von CaSO4 verwendet werden.
